Introduzione – L’osteoartrite (OA) è una patologia articolare degenerativa multifattoriale caratterizzata dalla progressiva degradazione della cartilagine articolare, dal rimodellamento dell’osso e dalla sinovite cronica. Le evidenze che si sono accumulate nell’ultimo decennio hanno stabilito che la disfunzione mitocondriale è un elemento centrale nella sua patogenesi, al di là dei fattori biomeccanici tradizionalmente considerati [1]. Questo articolo esamina in modo esaustivo i meccanismi molecolari sottostanti e valuta il potenziale terapeutico emergente dei prodotti delle api nella modulazione della funzione mitocondriale.
Basi molecolari della disfunzione mitocondriale nell’OA
Alterazioni della catena di trasporto degli elettroni (ETC) – La disfunzione mitocondriale nei condrociti articolari è caratterizzata da alterazioni significative dei complessi ETC:
1. Complesso I (NADH deidrogenasi)
- – Riduzione significativa dell’attività enzimatica
- – Alterato trasferimento di elettroni
- – Aumento della produzione di superossido
2. Complesso III (citocromo bc1)
- – Disaccoppiamento del trasporto di elettroni
- – Aumento della produzione di ROS
- – Compromissione della generazione del gradiente protonico
3. Complesso IV (citocromo c ossidasi)
- – Diminuzione dell’attività enzimatica
- – Compromissione della riduzione finale dell’ossigeno
- – Compromissione della sintesi di ATP
Disregolazione del controllo di qualità mitocondriale (MQC)
Biogenesi mitocondriale – L’omeostasi del MQC è gravemente compromessa nell’OA, con ripercussioni su molteplici processi regolatori [2]:
1. Via PGC-1α
- – Ridotta espressione dei fattori di trascrizione mitocondriali
- – Alterata sintesi proteica mitocondriale
- – Compromissione della replicazione del mtDNA
2. Dinamica mitocondriale
- – Alterazione delle proteine di fissione (DRP1, FIS1)
- – Squilibrio nell’espressione delle proteine di fusione (MFN1/2, OPA1)
- – Compromissione della rete mitocondriale
Sistemi di controllo della qualità delle proteine
1. Proteine chaperone (vedi definizione a: https://it.wikipedia.org/wiki/Chaperone_molecolare)
- – Alterazione di proteine chaperone HSP60 (mitocondriale) e HSP70 (citosolica)
- – Compromissione del ripiegamento delle proteine
- – Accumulo di proteine mal ripiegate
2. Sistema ubiquitina-proteasoma
- – Disfunzione nella degradazione selettiva
- – Alterazione dell’omeostasi proteica
- – Accumulo di proteine danneggiate
Profilazione trascrittomica e regolazione genica
Recenti analisi multi-omiche (le tecnologie multi-omiche consentono di analizzare simultaneamente un gran numero di molecole, come proteine, grassi, prodotti del metabolismo e marker infiammatori, separandoli gli uni dagli altri grazie alla spettrografia di massa) hanno identificato modelli specifici di disregolazione genica [3]:
1. Geni legati alla funzione mitocondriale
- – Alterazione dei geni del metabolismo energetico
- – Disregolazione dei geni ETC
- – Modifiche nei geni del controllo di qualità
2. Marcatori di attivazione dei macrofagi
- – Aumento dell’espressione di citochine pro-infiammatorie
- – Alterazione della polarizzazione M1/M2 (ci sono 2 stati polarizzati dei macrofagi associati al tumore: Le cellule TAM-1 (M1) facilitano l’uccisione dei tumori da parte delle cellule T. Le cellule TAM-2 (M2) promuovono la tolleranza al tumore)
- – Modifica della segnalazione immunitaria
Ruolo dell’invecchiamento
La diminuzione dell’espressione di LONP1 (è una proteasi mitocondriale) legata all’età rappresenta un meccanismo critico [4]:
1. Alterazioni in LONP1 1.
- – Ridotta degradazione delle proteine ossidate
- – Compromissione della funzione mitocondriale
- – Accumulo di danno ossidativo
2. Conseguenze funzionali
- – Aumento dello stress ossidativo
- – Alterazione dell’omeostasi proteica
- – Compromissione della funzione dei condrociti
Meccanismi molecolari della risposta catabolica
L’attivazione mediata dai ROS della via JNK/AP1 (enzima della famiglia delle chinasi) innesca una cascata catabolica [5]:
1. Segnalazione ROS-dipendente
- – Attivazione di chinasi da stress
- – Fosforilazione di fattori di trascrizione
- – Induzione di geni catabolici
2. Conseguenze nella cartilagine
- – Aumento dell’espressione delle MMP (Metallo Proteinasi di Matrice)
- – Attivazione di vie apoptotiche (l’apoptosi è un fenomeno controllato geneticamente che determina la morte programmata di una cellula a un certo punto del suo ciclo vitale)
- – Degradazione della matrice extracellulare
Potenziale terapeutico dell’apiterapia: analisi molecolare
Meccanismi d’azione del veleno
La melittina, il principale componente del veleno, ha dimostrato effetti significativi a livello molecolare [6]:
1. Modulazione della via AMPK/mTOR
- – Attivazione di AMPK (sistema delle proteine chinasi AMP dipendenti. Il sistema delle proteine chinasi AMP dipendenti definisce una famiglia di proteine presenti su quasi tutte le cellule umane che hanno la funzione di “sensore” dello stato energetico della cellula)
- – Inibizione di mTOR (una protein-chinasi)
- – Induzione della mitofagia (evento cellulare di autofagia che porta alla degradazione selettiva dei mitocondri)
2. Effetti sulla funzione mitocondriale
- – Potenziamento della bioenergetica mitocondriale
- – Riduzione dello stress ossidativo
- – Ottimizzazione del controllo di qualità
COMPOSTI BIOATTIVI DEL MIELE
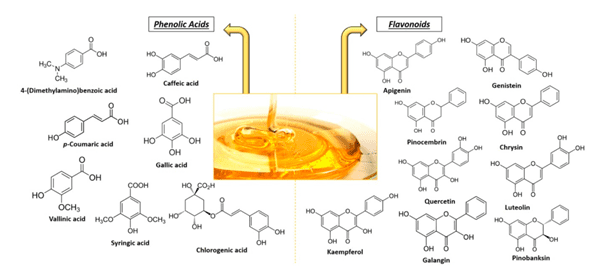
I componenti del miele esercitano effetti pleiotropici [7]: (fenomeno per cui un singolo gene controlla più di un carattere fenotipico)
1. Modulazione dello stress ossidativo
- – Attivazione di vie antiossidanti
- – Regolazione degli enzimi detossificanti
- – Protezione dal danno ossidativo
2. Effetti antinfiammatori
– Inibizione di NF-κB (NF–κB (“nuclear factor kappa-light-chain-enhancer of activated B cells” è un complesso proteico funzionante come fattore di trascrizione. E’ coinvolto in tutte le reazioni delle cellule agli stimoli, quali stress, citochine, radicali liberi, irradiazione con ultravioletti e attacco proveniente dagli antigeni dei batteri o virus.)
- – Modulazione delle citochine pro-infiammatorie
- – Regolazione dell’attivazione dei leucociti
Implicazioni per la pratica clinica
Stratificazione dei pazienti
1. Biomarcatori della funzione mitocondriale
- – Valutazione dei metaboliti energetici
- – Misurazione dei marcatori di stress ossidativo
- – Analisi della funzione mitocondriale nelle cellule periferiche
2. Monitoraggio terapeutico
- – Monitoraggio dei parametri bioenergetici
- – Valutazione dei marcatori infiammatori
- – Monitoraggio della progressione articolare
Protocollo terapeutico proposto
1. Valutazione iniziale
- – Caratterizzazione del profilo metabolico
- – Analisi di biomarcatori specifici
- – Valutazione della funzione mitocondriale
2. Intervento terapeutico
- – Dosaggio personalizzato dei prodotti delle api
- – Monitoraggio della risposta
- – Adattamento terapeutico in base all’evoluzione
Conclusioni e prospettive future
La comprensione dettagliata dei meccanismi molecolari che collegano la disfunzione mitocondriale e l’OA ha aperto nuove prospettive terapeutiche. L’apiterapia, grazie ai suoi effetti modulatori sulla funzione mitocondriale, emerge come una strategia promettente.
Traduzione a cura di Laura Cavalli della newsletter di WAO – World Apitherapy Organization
Referenze bibliografiche
1. Qi, Z., Zhu, J., Cai, W., Lou, C., & Li, Z. (2024). The Role and Intervention of Mitochondrial Metabolism in Osteoarthritis. Molecular and Cellular Biochemistry, 479(6), 1513-1524. https://doi.org/10.1007/s11010-023-04818-9
2. Liu, D., Cai, Z. J., Yang, Y. T., et al. (2022). Mitochondrial Quality Control in Cartilage Damage and Osteoarthritis: New Insights and Potential Therapeutic Targets. Osteoarthritis and Cartilage, 30(3), 395-405. https://doi.org/10.1016/j.joca.2021.10.009
3. Wu, Y., Hu, H., Wang, T., et al. (2024). Characterizing Mitochondrial Features in Osteoarthritis Through Integrative Multi-Omics and Machine Learning Analysis. Frontiers in Immunology, 15, 1414301. https://doi.org/10.3389/fimmu.2024.1414301
4. He, Y., Ding, Q., Chen, W., et al. (2022). LONP1 Downregulation With Ageing Contributes to Osteoarthritis via Mitochondrial Dysfunction. Free Radical Biology & Medicine, 191, 176-190. https://doi.org/10.1016/j.freeradbiomed.2022.08.038
5. Ansari, M. Y., Ahmad, N., Voleti, S., et al. (2020). Mitochondrial Dysfunction Triggers a Catabolic Response in Chondrocytes via ROS-mediated Activation of the JNK/AP1 Pathway. Journal of Cell Science, 133(22), jcs247353. https://doi.org/10.1242/jcs.247353
6. Chen, M., Wang, X., Bao, S., et al. (2024). Orchestrating AMPK/mTOR Signaling to Initiate Melittin-Induced Mitophagy: A Neuroprotective Strategy Against Parkinson’s Disease. International Journal of Biological Macromolecules, 281(Pt 1), 136119. https://doi.org/10.1016/j.ijbiomac.2024.136119
7. Martinez-Armenta, C., Camacho-Rea, M. C., Martínez-Nava, G. A., et al. (2021). Therapeutic Potential of Bioactive Compounds in Honey for Treating Osteoarthritis. Frontiers in Pharmacology, 12, 642836. https://doi.org/10.3389/fphar.2021.642836




